Fotofisica in slow motion: come studiare il moto atomico di una proteina per determinarne la funzione biologica
Le emoproteine rappresentano una famiglia di macromolecole presenti in numerosi organismi viventi, in grado di svolgere svariate funzioni biologiche, che spaziano dal trasporto di ossigeno, alla catalisi comprendendo anche l’immagazzinamento intracellulare. Lo Sviluppo tecniche in grado di mappare i riarrangiamenti strutturali e di identificare i siti attivi coinvolti durante processi di reazione foto-indotte rappresenta una sfida particolarmente complessa ma al tempo stesso estremamente ambiziosa nel campo della spettroscopia ultraveloce, fondamentale per comprendere da una prospettiva microscopica i meccanismi fisico-chimici che regolano il funzionamento di questa classe di proteine.
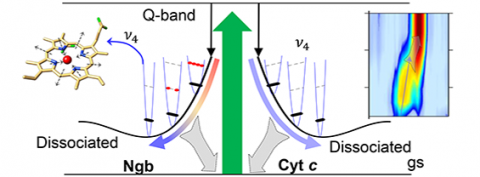
La dinamica di reazione si esaurisce in pochi picosecondi ed è caratterizzata da numerosi processi in competizione tra loro, come la riconfigurazione strutturale, la rottura o la formazione di legami, la ridistribuzione di energia ed il rilassamento su diversi stati elettronici eccitati. Mappare questi fenomeni, chiarendo come si combinino tra loro permettendo il processo di reazione, rappresenta una sfida particolarmente complessa, dato che richiede una risoluzione spaziale su scala atomica, combinata con tempi di esposizione del femtosecondo, due requisiti difficilmente conciliabili a causa del principio di indeterminazione di Heisenberg Una ricerca coordinata dal gruppo Femtoscopy del Dipartimento di Fisica della “Sapienza”, in collaborazione con l’Ecole Polytechnique di Parigi, ha dimostrato come ottenere la risoluzione spaziale e temporale necessarie per seguire l'evoluzione ultraveloce di due prototipi di emoproteine, il Citocromo (Cyt) e la Neuroglobina (Ngb), realizzando un vero e proprio filmato molecolare della loro fotoreazione. “L’idea di base è quella di utilizzare impulsi di luce al femtosecondo per depositare energia all’interno della molecola in questione” spiegano Giovanni Batignani e Carino Ferrante.
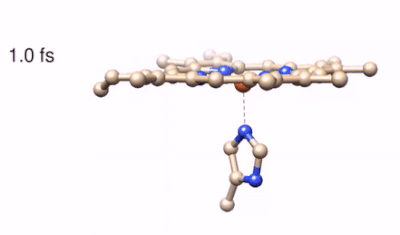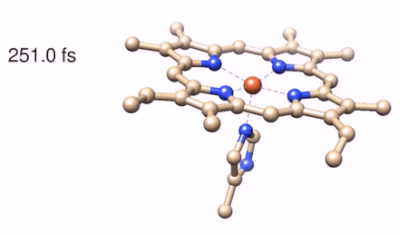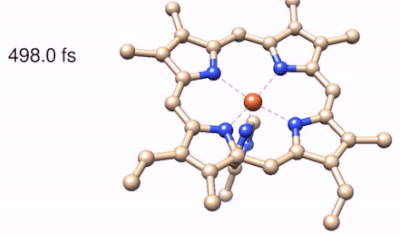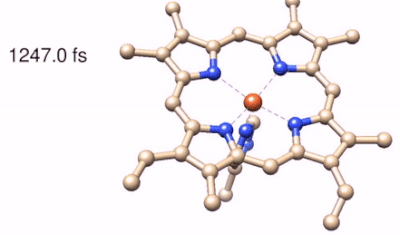 |
Il processo di reazione viene successivamente “fotografato” tramite l’utilizzo di altri due impulsi di luce che agiscono simultaneamente sul campione e ne misurano lo spettro Raman stimolato. “L’utilizzo di questo processo nonlineare, effettuato con l’impiego di fasci laser di proprietà spettrali e temporali opportune, è stata la chiave per aggirare il principio di indeterminazione combinando un’elevata risoluzione spettrale con una precisione temporale del femtosecondo nella stimolazione delle coerenze vibrazionali” prosegue Tullio Scopigno, coordinatore della ricerca. La tecnica, che prende il nome di Femtosecond Stimulated Raman Scattering, ha permesso di individuare i modi Raman transienti marker della fotolisi, dalle cui posizioni è stato possibile ricostruire le geometrie transienti delle molecole, individuando al tempo stesso i canali vibrazionali che regolano i trasferimenti ultraveloci di energia. Lo studio ha svelato peculiari dinamiche di fotoreazione per il Citocromo e la Neuroglobina. A differenza della più nota emoglobina, dove in seguito alla fotolisi di un legame chimico tra il ferro e l’ossigeno si ha il rilascio di quest’ultimo, nel caso di Ngb e Cyt la fotolisi coinvolge un amminoacido (rispettivamente istidina e metionina): quest’ultimo rimane confinato in prossimità della globina e, grazie ad un riarrangiamento strutturale combinato con una rapida dissipazione dell’energia termica sviluppata in seguito ad assorbimento di luce, riesce a ricombinarsi rapidamente con il nucleo dell’emoproteina, che torna quindi alla struttura di partenza in pochi picosecondi.
La ricerca, da poco pubblicata sul Journal of the American Chemical Society, rappresenta un importante passo avanti nello studio della foto-fisica delle emoproteine ed apre una prospettiva nuova per lo studio di fenomeni ultraveloci nelle biomolecole.
Reference
Journal of the American Chemical Society
Autori
Carino Ferrante, Giovanni Batignani, Emanuele Pontecorvo, Linda C. Montemiglio, Marten H. Vos, Tullio Scopigno
